dr hab. Michał R. Szymański, prof. UG i dr Anna Karłowicz autorami publikacji w prestiżowym JACS
Z ogromną radością przyjęliśmy wiadomość, iż artykuł zatytułowany "Human EXOG Possesses Strong AP Hydrolysis Activity: Implication on Mitochondrial DNA Base Excision Repair" został opublikowany w prestiżowym czasopiśmie naukowym Journal of the American Chemical Society (JACS). Pierwszym i korespondencyjnym autorem publikacji jest dr hab. Michał R. Szymański, prof. UG Kierownik Zakładu Biologii Strukturalnej MWB. Drugim autorem jest Asystent z danego zakładu dr Anna Karłowicz. Journal of the American Chemical Society, w najnowszym zestawieniu Journal Citation Reports, otrzymało Impact Factor równy 16.383 oraz posiada najwyższą możliwą punktację Ministerstwa Edukacji i Nauki, czyli 200 pkt!
Link do publikacji: https://doi.org/10.1021/jacs.2c10558
Mitochondria są niezbędne do życia komórki eukariotycznej ze względu na ich kluczową rolę w zasadniczych szlakach metabolicznych. Bliskość łańcucha oddechowego, który jest źródłem reaktywnych form tlenu (ROS) w mitochondriach, sprawia, że DNA mitochondrialny (mtDNA) jest znacznie bardziej narażony na stres oksydacyjny niż DNA jądrowy. Odkrycie, że nienaprawione uszkodzenia prowadzą do destabilizacji genomu mitochondrialnego, a w rezultacie do starzenia się i wielu poważnych chorób u ludzi, rozpoczęło intensywne badania nad mechanizmami naprawy mtDNA. Nadal jednak procesy naprawcze w mitochondriach nie zostały w pełni poznane i wiele fundamentalnych pytań nadal wymaga odpowiedzi.
Większość uszkodzeń oksydacyjnych w mtDNA jest naprawiane dzięki ścieżce wycięcia zasady (ang. Base Excision Repair, BER), w którą zaangażowanych jest wiele enzymów. Jednak enzym mitochondrialny odpowiedzialny za usuwanie fosforanu deoksyrybozy (dRP) z końca 5’ nie został dotychczas opisany. 5’-dRP tworzy się po usunięciu uszkodzonej zasady (tworząc w ten sposób miejsce AP) oraz nacięciu szkieletu cukrowo-fosforanowego DNA. Dzięki analizom strukturalnym i enzymatycznym w naszej pracy pokazaliśmy, że ludzka mitochondrialna egzonukleaza EXOG ma bardzo silną aktywność usuwania dRP. W przeciwieństwie do kanonicznych liaz dRP (np. naprawcza polimeraza Pol β w jądrze komórkowym), które usuwają wyłącznie nienaruszone dRP, EXOG jest zdolne do wycięcia różnych miejsc AP: (1) dRP, (2) deoksyrybonolaktonu dL – utlenionej forma dRP, oraz (3) tetrahydrofuranu THF – syntetycznego analogu dRP. Rozwiązaliśmy strukturę krystaliczną EXOG w kompleksie z DNA zawierającego THF, jak i z częściową przerwą nukleotydową. Otrzymane dane strukturalne wraz z analizami biochemicznymi pozwoliły nam na zaproponowanie mechanizmu aktywności EXOG na substratach DNA zawierających różne uszkodzenia. Pokazaliśmy, że dzięki kontrolowanej 5’-egzonukleolitycznej aktywności EXOG nacina trzecie wiązanie fosfodiestrowe od miejsca AP, co pozwala na usunięcie uszkodzenia w mtDNA niezależnie od jego rodzaju.
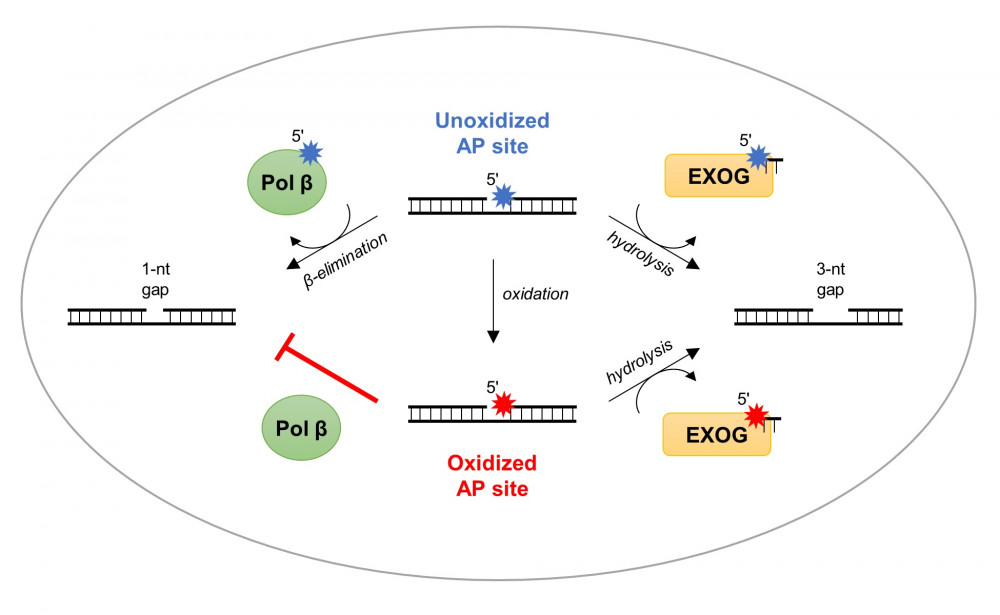
Szymański Michał R., Karłowicz Anna, Herrmann Geoffrey K., Cen Yana, Yin Y. Whitney. Human EXOG Possesses Strong AP Hydrolysis Activity: Implication on Mitochondrial DNA Base Excision Repair. Journal of the American Chemical Society 2023, (doi: 10.1021/jacs.2c10558)
Praca powstała w ramach grantu POLONEZ 2 Narodowego Centrum Nauki (NCN), którego dr hab. Michał R. Szymański, prof. UG był kierownikiem.
dr hab. Michał R. Szymański, prof. UG zachęca do zainteresowanych tematom badań do przyjrzenia się obecnie otwartym konkursom na pozycje doktoranta i technika w Zakładzie Biologii Strukturalnej. Więcej info na: www.mrslab.ug.edu.pl.
Najnowsze informacje o działalności Zakładu Biologii Strukturalnej można znaleźć na Twitter, @MRSzymanskiLab





